Können Gemische aus alpha- und beta-Halbhydrat mittels Thermoanalyse quantifiziert werden?
Zusammenfassung: Für die Herstellung hochwertiger Gipsbaustoffprodukte wird meist alpha-Halbhydrat eingesetzt. Die beta-Form dient zur Herstellung von Massenware. Aber auch Gemische beider Formen werden eingesetzt. Inwieweit aus Herstellungsverfahren bereits alpha-/beta-Halbhydratgemische resultieren bleibt mit der Frage nach einem Nachweisverfahren offen. Bisher wurde die thermische Analyse zur Quantifizierung in Betracht gezogen, da sich das alpha- und beta-CaSO4 ∙ 0,5 H2O durch einem exothermen Effekt bei verschiedenen Temperaturen unterscheiden. In Abhängigkeit von Kristallform und -größe ist dieser Effekt aber nicht einheitlich messbar. Ursache ist eine von der Kristallitform abhängige Kinetik der Phasenumbildung mit steigender Temperatur. Die Thermoanalyse scheidet daher für die quantitative Analyse von alpha-/beta-Gemischen aus.
1 Einleitung
Calciumsulfat-Halbhydrat (CaSO4 ∙ 0,5 H2O) wird aus Gips (CaSO4 ∙ 2 H2O) durch partielle Entwässerung auf zwei verschiedenen Wegen hergestellt. In Gegenwart von hohen Wasserdampfpartialdrücken zwischen 80 °C und 120 °C (hydrothermal im Autoklav), aber auch in Säuren oder Salzlösungen oberhalb 45 °C bildet sich das Halbhydrat in Form gut ausgebildeter hexagonaler Prismen (Bild 1a). Bei niedrigem Wasserdampfpartialdruck, so bei der Entwässerung von Gips an der Luft oder im Vakuum zwischen 45 °C und 200 °C, entsteht die so genannte beta-Form des Halbhydrats (Stuckgips), welche...
1 Einleitung
Calciumsulfat-Halbhydrat (CaSO4 ∙ 0,5 H2O) wird aus Gips (CaSO4 ∙ 2 H2O) durch partielle Entwässerung auf zwei verschiedenen Wegen hergestellt. In Gegenwart von hohen Wasserdampfpartialdrücken zwischen 80 °C und 120 °C (hydrothermal im Autoklav), aber auch in Säuren oder Salzlösungen oberhalb 45 °C bildet sich das Halbhydrat in Form gut ausgebildeter hexagonaler Prismen (Bild 1a). Bei niedrigem Wasserdampfpartialdruck, so bei der Entwässerung von Gips an der Luft oder im Vakuum zwischen 45 °C und 200 °C, entsteht die so genannte beta-Form des Halbhydrats (Stuckgips), welche stark zerklüftet noch die äußere Form des ursprünglichen Dihydrats aufweist (Bild 1b).
Die unterschiedlichen Oberflächenverhältnisse der beiden Formen spiegeln sich u. a. im Abbindeverhalten wider. Die Dihydratbildung aus der a-Form erfolgt im Vergleich zur
beta-Form bedeutend langsamer, wobei höhere Festigkeiten erreicht werden. Das alpha-Halbhydrat wird daher zur Erzeugung hochwertiger Spezialbindemittel wie Formgipse, Verfugungsmaterialien für keramische Materialien, Spachtelmassen, Fließestriche oder Whiskers eingesetzt. Aus beta-Halbhydrat werden in großem Umfang Gipskartonplatten und Gips-Wandbauplatten hergestellt. Für einige Produktklassen werden beide Formen in Mischungen eingesetzt. Zum anderen besteht das Interesse, Gemische der beiden Formen zu quantifizieren, da solche auch aus dem Herstellungsprozess resultieren können. Die Halbhydratformen geben daher immer wieder Anlass zu Untersuchungen hinsichtlich ihrer physikalischen und chemischen Eigenschaften.
2 Kristallformen des alpha-CaSO4 ∙ 0,5 H2O
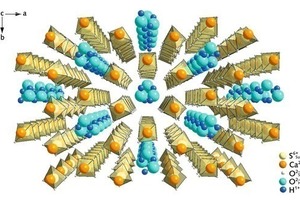
Dem Autoklavprozess zur a-Halbhydratherstellung werden Additive wie z. B. Carbonsäuren und deren Salze, Polymere oder auch anorganische Zusätze zur Beeinflussung der Kristallform beigefügt, um die Folgeschritte der Produktverarbeitung zu begünstigen. Dabei können feinfasrige, stäbchen- bis hin zu plättchenförmige Kristallite (Bild 2) erzeugt werden. Von erst- bis letztgenannter Morphologie erfolgt dabei eine Verkürzung der kristallografischen c-Achse, womit auch eine Verkürzung der „Wasserkanäle“ verbunden ist. In Bild 3 ist die Halbhydratstruktur mit entsprechender Blickrichtung entlang der „Wasserkanal“-Anordnung, d.h. entlang der kristallografischen c-Achse dargestellt.
3 Thermisches Verhalten
CaSO4 ∙ 0.5 H2O dehydratisiert in Abhängigkeit vom Wasserdampfpartialdruck zwischen 100 °C und 200 °C. Bei gewöhnlich niedrigem Dampfdruck, z. B. im offenen Tiegel mit trockenem Gasstrom während einer TG/DTA-Messung, beginnt die Wasserabgabe bei 100 °C und ist in Abhängigkeit von Einwaage und Heizrate zwischen 120 °C und 140 °C abgeschlossen. Dabei können die Wassermoleküle die Struktur (Bild 3) ungehindert verlassen, es entsteht eine wasserfreie Struktur: der lösliche Anhydrit (A III). Diese metastabile Phase wandelt sich kinetisch kontrolliert in den stabilen Anhydrit (A II) um (exotherme Reaktion).
Diese Umwandlung läuft für die a- und b-Form unterschiedlich ab. Für b-Halbhydrat wird ein breiter exothermer Effekt bei 350 °C – 375 °C beobachtet [2– 4]. Das Auftreten eines exothermen Effekts für das a-Halbhydrat bei tieferen Temperaturen unmittelbar nach der Entwässerung wird nicht einheitlich diskutiert. Nach BUDNIKOV [5] ist im Thermogramm des a-Halbhydrats kein exothermer Effekt zu beobachten. Dagegen wird von KUNTZE [3] ein solcher Effekt unterhalb 250 °C angegeben. Nach [2] und [4] tritt ein exothermer Effekt wasserdampfpartialdruckabhängig zwischen 163 °C und 255 °C auf. POWELL [2] bemerkte zudem in verschiedenen Proben mit gleicher Einwaage eine unterschiedliche Größe der exothermen Effekte.
TG/DTA-Untersuchungen an a-Halbhydratproben (Bild 4), wie in Bild 2 dargestellt, zeigen, dass lediglich die stäbchenförmige Probe einen exothermen Effekt im Anschluss an die Entwässerung aufweist. Für die Fasern wie auch das plättchenförmige Halbhydrat ist kein derartiger Effekt zu beobachten. Die Entwässerung selbst beginnt für die Plättchenform bei 90 °C und ist bei 125 °C abgeschlossen. Die Stäbchenform wie auch die Fasern verlieren ab 100 °C ihr Hydratwasser. Im Fall der Fasern verlassen die letzten Wassermoleküle die Struktur erst bei 160 °C, was auf die langen Austrittswege der H2O-Moleküle in Faserrichtung (kristallografische c-Achse) zurückzuführen ist. Mittels In-situ-Raman-Spektroskopie wurde der Phasenbestand unter entsprechender Temperaturerhöhung für die a-Halbhydratformen untersucht, um das Ausbleiben des exothermen Effekts im Fall der Fasern und des plättchenförmigen Halbhydrats zu deuten. Pulverdiffraktometrische Messungen sind aufgrund der identischen Reflexlagen von Halbhydrat und A III dafür nicht geeignet.
Das thermische Verhalten von b-Halbhydrat ist in Bild 5 dargestellt. Exemplarisch wurden zwei b-Halbhydrate vermessen, welche sich hinsichtlich der Herkunft des Ausgangsgipses unterscheiden. Der bekannte Unterschied zu a-Halbhydraten zeigt sich in der zu deutlich höheren Temperaturen verschobenen A III - A II-Umwandlung (zwischen 350 °C und 400 °C). Der entsprechende exotherme Effekt variiert in seiner Ausprägung wiederum in Abhängigkeit von der Herkunft des Ausgangsgipses sowie der verfahrenstechnischen Aufbereitung.
4 In-situ-Raman-Spektroskopie
CaSO4-Phasen können anhand der Molekülschwingungen des Sulfat-Ions mittels Raman-Spektroskopie identifiziert werden (Bild 6). In einer Specac Temperaturzelle 21525, welche an das Raman-Spektrometer RFS 100/S mit Nd:YAG-Laser der
Fa. Bruker adaptiert werden kann, wurde die Umwandlung der a-Halbhydratkristallformen und vergleichend die eines
b-Halbhydrats ausgehend von Raumtemperaturen bis 220 °C anhand der Veränderung der Sulfatbanden untersucht. In
Bild 7 sind die jeweiligen Ausschnitte aus den Raman-Spektren der a-Halbhydratformen für die symmetrische Valenzschwingung (ns) dargestellt. Im Fall des fasrigen Halbhydrats bildet
sich ab 95 °C neben der ns-Bande des CaSO4 ∙ 0.5 H2O bei 1015 cm-1 die ns-Bande des A III bei 1026 cm-1 aus, welche mit steigender Temperatur an Intensität gewinnt. Ab 165 °C beginnt sich die ns-Bande des A II als Schulter bei 1017 cm-1
anzudeuten, welche bis 220 °C nur weniger intensiv wird.
Die Hauptphase bleibt bis zu dieser Temperatur der A III. Ähnlich zeigt sich die Phasenbildung im Fall der Plättchen.
Die A-III-Bande ist bei 110 °C neben der des Halbhydrats deutlich ausgebildet. Die Bildung des A II beginnt ab 165 °C. Bis 220 °C bleibt auch hier der A III neben A II erhalten, welcher sich im Vergleich zu den Fasern nur wenig schneller bildet. Anders für die Stäbchenform; hier setzt die A-II-Bildung erst oberhalb 180 °C ein und bei 220 °C stellt dieser bereits den Haupanteil neben A III dar. Das Temperatur-Zeit-Intervall der
A-III-Umwandlung ist hier deutlich
kleiner, sodass entsprechend der TG/DTA-Messung diese als exothermer Effekt sichtbar wird.
Der Zusammenbruch der wasserfreien Gerüststruktur des Halbhydrats (A III) hängt scheinbar stark von den Oberflächenverhältnissen der ursprünglichen Halbhydratphase ab, sodass die Umwandlung des A III in A II zum einen sehr langsam über einen weiten Temperaturbereich erfolgen kann, wobei die frei werdende Wärme kaum messbar wird. Erfolgt die Umwandlung aber
in kurzer Zeit, kann ein deutlicher thermischer Effekt detektiert werden. Derartige Unterschiede können auch durch mechanische Beanspruchung wie durch das Aufmahlen von CaSO4 ∙ 0.5 H2O-Kristalliten hervorgerufen werden [6].
Für das b-Halbhydrat konnte bis 220 °C nur die Bildung des A III beobachtet werden, was mit der TG/DTA-Kurve (Bild 5) im Einklang steht. Für Messungen bis zur Umwandlungstemperatur des A III in A II ist die Specac-Zelle mit Maximaltemperatur bis 220 °C nicht ausgelegt.
5 Schlussfolgerung
Die Frage nach einem quantitativen Nachweisverfahren für a-/b-Halbhydratgemische bleibt nach wie vor offen. Bekanntlich sind die beiden Formen des CaSO4 ∙ 0,5 H2O röntgenographisch nicht unterscheidbar. Die bisher in Betracht gezogene thermische Analyse scheidet als Quantifizierungsmethode ebenso aus, da sich beide Formen zwar in der Regel durch das Auftreten eines exothermen Effektes bei verschiedenen Temperaturen unterscheiden, dieser Effekt aber je nach Kristallhabitus und Kristallitgröße nicht einheitlich messbar wird.

tab ZKG KOMBI Test
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.
tab ZKG KOMBI Study Test
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.