Bildung von intermediären Phasen bei der Hydratation von C3S
BAUHAUS UNIVERSITY WeimarDie beschriebenen Modellvorstellungen können als Grundlage für die Entwicklung von Bindemitteln dienen, die einen deutlich geringeren Energieinhalt aufweisen und somit geringere spezifische Kohlendioxid-Emissionen.
1 Einleitung
1 Einleitung
Bei den Bemühungen zur Reduktion der Umweltbelastung spielt die Substitution von Portlandzementklinker durch latent-hydraulische, inerte und puzzolanische Stoffe eine wichtige Rolle. Unabhängig davon kommt dem Portlandzementklinker hinsichtlich der produzierten Mengen und der Bedeutung für die Festigkeitsentwicklung immer noch eine überragende Funktion zu. Insbesondere für die Produktion von Zementen mit schneller Festigkeitsentwicklung ist ein Verzicht auf Portlandzementklinker weiterhin undenkbar.
Vor diesem Hintergrund ist ein Verständnis der grundlegenden Prozesse der Zementhydratation erforderlich, um mögliche Alternativen zum Portlandzementklinker beurteilen zu können. Bei diesen Untersuchungen wird in der Regel Tricalciumsilikat (Ca3SiO5, C3S) verwendet, da diese Verbindung in fremdoxidreicher Form (Alit) den Hauptbestandteil des Portlandzementklinkers bildet und wichtigster Träger der hydraulischen Erhärtung ist.
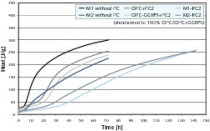
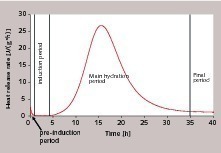
Die Reaktion von C3S mit Wasser zu röntgenamorphen C-S-H Phasen und Calciumhydroxid wird bereits seit über 100 Jahren untersucht. Es wird davon ausgegangen, dass der Ausgangsstoff im Anmachwasser bzw. der Porenlösung in Calcium-, Silikat- und Hydroxidionen dissoziiert und die Reaktionsprodukte aus der übersättigten Lösung ausfallen. Es handelt sich dabei um einen kontinuier-lichen Lösungs-Fällungs-Prozess, dessen Umsatzraten über den gesamten zeitlichen Verlauf deutlich variieren. Dies kann besonders einfach durch die Messung der Reaktionswärme belegt werden und aufgrund derartiger Messungen wurde der Prozess in verschiedene zeitliche Stufen eingeteilt (Bild 1).
Nach einer initialen Wärmefreisetzung in der „pre-induction period“ kommt es zu einer scheinbaren Ruhephase, die als „dormant period“ oder „induction period“ bezeichent wird. Allgemein wird die Wärmefreisetzung in den ersten Minuten auf das Ablöschen des Freikalks, die Benetzung des Feststoffs mit Wasser, die Auflösung einer geringen C3S-Menge und die Bildung erster Hydratphasen zurückgeführt, wobei die Beiträge der genannten Einzelreaktionen nur schlecht quantifizierbar sind. Die anschließende Induktionsphase der Haupthydratation ist technologisch sehr wichtig, da sie Transport, Einbau und Verdichtung des hergestellten Betons ermöglicht. Bei experimentellen Untersuchungen wurde beobachtet, dass die Länge der Induktionsphase sehr unterschiedlich sein kann. Die Dauer dieses Abschnittes wird insbesondere von den Eigenschaften des C3S, der Reaktionstemperatur und der Zugabe beschleunigender und verzögernder Stoffe beeinflusst
Die Ursachen für die zeitliche Verzögerung der Haupthydratation durch das Auftreten einer Induktionsperiode sind umstritten. Es wurde bereits frühzeitig angenommen, dass die Bildung einer Hydrathülle um die C3S-Partikel dafür verantwortlich ist. Weiterhin wurde davon ausgegangen, dass als erstes Hydratationsprodukt ein metastabiles Calciumsilikathydrat auftritt, welches in einem zweiten Schritt in C-S-H als stabiles Endprodukt umgewandelt wird [2, 3]. Allerdings konnte die Bildung dieses Zwischenproduktes zum damaligen Zeitpunkt nicht experimentell belegt werden [4]. In der Folgezeit wurden verschiedene spektroskopische Verfahren angewendet, um einen solchen Nachweis zu erbringen [5-9]. In diesen Untersuchungen wurde gezeigt, dass verschiedene chemische und physikalische Modifizierungen an der Oberfläche eintreten. Besonders wichtig war die Feststellung, dass die primären Hydratphasen unkondensierte Silikattetraeder (Monomere) enthalten, während die stabilen C‑S-H Phasen Dimere und kurze Ketten, d. h. kondensierte Silikatverbindungen enthalten. Obwohl die genannten Untersuchungen hinsichtlich des Nachweises einer intermediären Verbindung erfolgreich waren, konnte nicht gezeigt werden, dass die gesamte C3S-Oberfläche davon bedeckt ist. Demzufolge war die Bildung einer vollständigen Hülle (Bild 2) nicht belegt und die spektroskopischen Befunde auch durch die Anwesenheit von Clustern der intermediären Phase auf der C3S-Oberfläche erklärbar (Bild 3). Aus diesem Grund wurden alternative Mechanismen für die Existenz der Induktionsperiode vorgeschlagen. In einem Modell wurde eine Fällung von Keimen der stabilen C-S-H Phasen bereits in den ersten Minuten diskutiert. Alle weiteren kinetischen Schritte wurden auf die Modifizierung von Umsatzraten der Lösungs-Fällungs-Reaktion durch die Zusammensetzung der Porenlösung und die Größe der angebotenen Wachstumsfläche zurückgeführt [10]. Eine weitere Hypothese geht davon aus, dass die Reaktionsgeschwindigkeit von der Auflösungsgeschwindigkeit des C3S abhängt, welche ihrerseits von der Defektdichte im Kristallgitter des C3S und der Zusammensetzung der Lösung beeinflusst wird [11].
Im vorliegenden Beitrag werden experimentelle Untersuchungen zum Nachweis einer intermediären Verbindung bei der Hydratation von C3S vorgestellt. Dies erfolgte durch eine Anreicherung dieser Phase und die Analyse mittels Kernresonanzspektroskopie. In einer weiteren Untersuchung wurde die Oberfläche von C3S während der Hydratation durch Röntgen-Photoelektronenspektroskopie untersucht. Dabei sollte festgestellt werden, ob tatsächlich die gesamte Oberfläche von dem Zwischenprodukt bedeckt ist. Auf der Basis der erhaltenen Ergebnisse werden die energetischen Grundlagen der C3S-Hydratation diskutiert.
2 Nachweis einer Zwischenphase mittels
Kernresonanzspektroskopie [13]
Für die Untersuchungen wurde reines C3S in Iso-propanol auf eine Feinheit von etwa 21 m²/g (BET) aufgemahlen. Das Mahlprodukt enthielt Partikel mit einem Durchmesser zwischen 50 und 200 nm. Die Bildung der intermediären Phase wurde nach einer sehr kurzen Hydratationsdauer untersucht. Aufgrund der hohen Feinheit war für die Herstellung einer Paste ein Wasser/Feststoff-Wert von 1,2 erforderlich. Nach einer Hydratationszeit von 5 Minuten wurde die Reaktion thermisch abgestoppt. Die hydratisierte und die unhydratisierte Probe wurden mittels verschiedener Verfahren, darunter thermische Analyse, Röntgendiffraktometrie, Kernresonanzspektroskopie und Elektronenmikroskopie untersucht [13]. Im vorliegenden Beitrag sollen hauptsächlich die Resultate der Kernresonanzspektroskopie (NMR) vorgestellt werden. Mittels 29Si MAS NMR können Unterschiede in der chemischen Umgebung der Siliziumkerne erfasst werden. Die Koordination, der Kondensationsgrad und der mittlere Si-O Abstand zeigen (in unterschiedlichem Umfang) einen Einfluss auf die lokalen Magnetfelder in der Umgebung der untersuchten Kerne und somit die chemischen Verschiebungen im NMR-Spektrum. Die „single pulse“ Aufnahmen erfolgten bei einer Magnetfeldstärke von 9,4 T (Varian INOVA-400) und einem „flip angle“ von 45 Grad in Rotoren mit einem Volumen von 220 µl. Die Verringerung der spektralen Breite und Vermeidung von Rotationsseitenbändern erfolgte durch Rotation um den magischen Winkel (MAS).
Die Ergebnisse der NMR-Untersuchungen sind in Bild 4 dargestellt. Die trikline Kristallstruktur von C3S besitzt 9 unterschiedliche Silizium-Gitterplätze, die üblicherweise zur Beobachtung von acht NMR-Peaks führen, wobei ein Peak die doppelte Intensität aufweist. Im Gegensatz dazu zeigt das NMR-Spektrum des unhydratisierten, feingemahlenen C3S in Bild 4 (oben) stark verbreiterte Resonanzen. Eine Unterscheidung der einzelnen Gitterplätze ist nicht mehr möglich. Dies ist vermutlich auf die kleinen Partikelgrößen zurückzuführen, die eine starke Fehlordnung und somit unterschiedliche Si-O Bindungslängen bewirken. Nach fünf Minuten Hydratation sind nur geringe Änderungen im „single pulse“ Spektrum zu beobachten (Bild 4, Mitte). Insbesondere sind keine Anzeichen für die Anwesenheit von kondensierten Siliziumtetraedern (Q1 und Q2) vorhanden, wie sie üblicherweise in C‑S-H auftreten. Lediglich unkondensierte Siliziumspezies (Q0) werden nachgewiesen.
Die zusätzliche Aufnahme mittels 29Si{1H} cross polarization (CP) zeigt an, dass sich ein großer Teil der Siliziumtetraeder in unmittelbarer Nähe von Wasserstoffkernen befindet, da ein direkter Transfer der Magnetisierung von 1H auf 29Si möglich ist. Daraus kann abgeleitet werden, dass ein hoher Anteil des Siliziums bereits als Calciumsilikathydrat gebunden ist. Dabei handelt es sich jedoch nicht um die stabilen C-S-H Phasen mit kondensierten Siliziumtetraedern, sondern um eine Phase, welche Silizium in monomerer Form enthält (intermediäre Phase). Eine Abschätzung des Hydratationsgrades aus der CP-Aufnahme ist durch eine experimentelle Bestimmung des CP-gain factors unter identischen Bedingungen in einem inversion-recovery-Experiment möglich. Mit Hilfe dieses Wertes konnte berechnet werden, dass die Probe bereits nach fünf Minuten Hydratationszeit aus 79 % intermediärer Phase und 21 % C3S besteht. Stabile C-S-H Phasen als Endprodukt der Reaktion wurden in dieser Probe nicht nachgewiesen. Zusätzliche Analysen an anderen Proben zeigten, dass im weiteren zeitlichen Verlauf eine Umwandlung des Zwischenproduktes in C-S-H beobachtet werden kann, es sich also tatsächlich um eine metastabile Verbindung handelt.
Mit den vorstehend beschriebenen Experimenten konnte gezeigt werden, dass eine große Menge an intermediärer Phase gebildet werden kann, wenn das Ausgangsmaterial eine sehr große Oberfläche aufweist. Es können jedoch keine Schlussfolgerungen gezogen werden, ob bei normalen Zementfeinheiten tatsächlich die gesamte Oberfläche bedeckt ist und die Bildung der intermediären Phase für die Verringerung der Reaktionsgeschwindigkeit in der Induktionsperiode verantwortlich ist.
3 Untersuchung des Bedeckungsgrades der Oberfläche
mittels XPS [14]
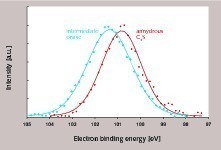
Aus anderen Untersuchungen war bereits bekannt, dass die Bindungsenergie der Si2p-Elektronen in C3S etwa 100,8 eV beträgt [15]. Nach der Umsetzung zu C-S-H Phasen werden Si2p-Bindungsenergien zwischen 102,0 und 102,5 eV [16] gemessen und diese sind dadurch von C3S relativ gut unterscheidbar. Weiterhin lagen Hinweise vor, dass auch die Si2p-Elektronen in der intermediären Phase bereits höhere Bindungsenergien als in C3S aufweisen [16]. Damit steht eine Methode zur Verfügung, die sowohl phasen- als auch oberflächensensitiv ist und somit zur Untersuchung des Bedeckungsgrades der C3S-Oberfläche in der Frühphase der Hydratation geeignet ist.
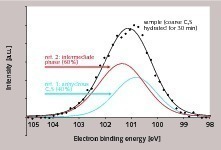
Ziel der hier vorgestellten Untersuchungen war die Bestimmung des Oberflächenanteiles, der in der Induktionsphase mit intermediärer Phase bedeckt ist. Dazu wurden drei Proben analysiert, wobei es sich um zwei Referenzen handelte (unhydratisiertes C3S, intermediäre Phase) und eine C3S-Probe aus der Frühphase der Hydratation. Für die Herstellung der unhydratisierten Referenz wurde C3S vor der Untersuchung zu einer Tablette gepresst und bei 1500 °C geglüht. Die Tablette wurde im Hochvakuum des XPS-Instruments gebrochen, um eine frische, unhydratisierte Oberfläche analysieren zu können. Die intermediäre Phase (Referenz 2) wurde analog zu den oben beschriebenen NMR-Untersuchungen aus nano-C3S hergestellt, da diese Analysen gezeigt hatten, das derartige Proben nahezu vollständig aus intermediärer Phase bestehen. Als eigentliche Probe wurde ein C3S mit langer Induktionsperiode ausgewählt (Bild 1) und die Hydratation nach 30 Minuten durch Waschen mit Isopropanol unterbrochen.
Die XPS-Untersuchungen erfolgten in einem Gerät (S‑Probe) der Fa. Surface Science Instruments, ausgestattet mit einer Al-Röntgenröhre. Unterschiedliche Aufladungen der einzelnen Proben wurden durch einen Bezug des Spektrums auf die C1s-Bindungsenergie von 248,80 eV korrigiert.
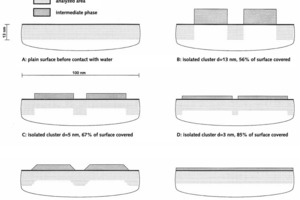
Die Si2p-Bindungsenergien der beiden Referenzproben sind in Bild 5 dargestellt. Es lässt sich erkennen, dass die intermediäre Phase und das unhydratisierte C3S unterschiedliche Si2p-Bindungsenergien aufweisen, die sich jedoch aufgrund der relativ hohen Halbwertsbreite partiell überlagern. Dementsprechend wird für die eigentliche Probe ein relativ breites Signal erhalten, welches sich in die Beiträge der beiden Referenzen (unhydratisiertes C3S, intermediäre Phase) aufspalten lässt (Bild 6). Daraus lassen sich die Anteile von C3S und intermediärer Phase im analysierten Volumen berechnen. Es wurden drei Probenstellen untersucht. Im Mittel wurden Gehalte von 56 % intermediärer Phase und 44 % C3S bestimmt. Hinweise für die Anwesenheit von stabilen C-S-H Phasen waren nicht vorhanden. Demzufolge wurde bei einem sehr geringen Hydratationsgrad (kleiner als 1 M.-%) eine sehr hohe Anreicherung der intermediären Phasen auf der Oberfläche des C3S nachgewiesen. Für die Auswertung der experimentellen Befunde wurden verschiedene geometrische Situationen berücksichtigt, die alle zu einer Konzentration von 56 % intermediärere Phase und 44 % C3S im analysierten Volumen führen würden (Bild 7). Der Mindestbedeckungsgrad liegt bei 56 %, wobei in diesem Fall relativ hohe Inseln oder Cluster aus intermediärer Phase auf der C3S-Oberfläche sichtbar sein müssten (Bild 7B). Geringere Schichtstärken erfordern einen höheren Bedeckungsgrad (Bilder 7C-7E). Bei einer homogenen Schichtstärke von etwa 2 nm und einer vollständigen Bedeckung würde sich gleichfalls das oben genannte Verhältnis von intermediärer Phase zu C3S im analysierten Volumen ergeben (Bild 7F). Welche der geometrischen Situationen aus Bild 7 tatsächlich zutreffend ist, kann mit Hilfe der hochauflösenden Rasterelektronenmikroskopie ermittelt werden. Bild 8 zeigt eine entsprechende Aufnahme. Es ist zu erkennen, dass die Oberfläche des C3S keine Stufen oder Absätze zeigt, wie dies in den Bildern 7B bis 7E angenommen wurde. Die Rauhigkeit der Oberfläche in Bild 8 ist kleiner als 2 nm und somit kann davon ausgegangen werden, dass nicht nur der größte Teil der C3S-Oberfläche bedeckt ist, sondern dass tatsächlich eine vollständige Bedeckung mit intermediärer Phase vorliegt. Dies bestätigt frühere Modelle [2, 3, 12] und darauf basierende schematische Darstellungen (Bild 2).
4 Thermodynamische Berechnungen zur
Hydratation von C3S
5 Ableitungen von Modellvorstellungen zur
C3S-Hydratation
6 Zusammenfassung
Aufgrund der Bildung einer intermediären Phase auf der Oberfläche direkt nach dem Anmachen mit Wasser wird eine Induktionsperiode vor der Haupthydratation beobachtet, die durch eine heterogene Keimbildung der stabilen Endprodukte beendet wird.
Die erste Teilreaktion beinhaltet bereits über 90 % der Triebkraft der Gesamtreaktion. Für den zweiten Teilschritt steht eine deutliche geringere Energieänderung zur Verfügung und dieser verläuft dadurch deutlich langsamer.
Die beschriebenen Modellvorstellungen können als Grundlage für die Entwicklung von Bindemitteln dienen, die einen deutlich geringeren Energieinhalt aufweisen und somit geringere spezifische Kohlendioxidemissionen. Weiterhin kann eine Verschiebung der Energieanteile zwischen den beiden Teilreaktionen die Gesamtreaktion von C3S mit Wasser beschleunigen.
7 Danksagung

tab ZKG KOMBI Test
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.
tab ZKG KOMBI Study Test
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.
Es handelt sich hierbei um ein Testangebot. Es berechtigt zu keinem gültigen Abonnement und steht hier rein für Testläufe. Bitte diesem Prozess nicht folgen.

![Bildung eines kontinuierlichen Saumes aus Reaktionsprodukten auf der Oberfläche der C3S-Partikel in der Frühphase der Hydratation [12]](https://www.zkg-online.info/imgs/tok_2942f20087bb7800ec8e2766242cf0a0/w300_h200_x389_y828_101516306_354cd21e50.jpg)
![Bildung isolierter Cluster der intermediären Phase (hier bezeichnet als C-S-H) auf der Partikeloberfläche von C3S direkt nach dem Kontakt mit Wasser [11]](https://www.zkg-online.info/imgs/tok_e7132e0be385b3c666cac6b9e94719b0/w300_h200_x196_y326_101516318_524fb64b4f.jpg)
![Ergebnisse der 29Si MAS NMR Spektroskopie [13]: Oben – „single pulse“ Aufnahme des unhydratisierten nano-C3S (vr=6 kHz, 60 s Pulswiederholzeit, 1344 Pulse); Mitte – „single pulse“ Aufnahme des nano-C3S nach 5 Minuten Hydratation (vr=6 kHz, 60 s Pulswiederholzeit, 1360 Pulse); Unten – 29Si{1H} CP Aufnahme des nano-C3S nach 5 Minuten Hydratation (vr=3 kHz, 10 s Pulswiederholzeit, CP-Kontaktzeit=1 ms, 2304 Pulse)](https://www.zkg-online.info/imgs/tok_d3b30a5565ec4c173767b48798e80aea/w300_h200_x157_y120_101516315_b804f62988.jpg)

![Änderung der Freien Reaktionsenthalpie bei der Hydratation von C3S in einem Schritt (links) bzw. in zwei Schritten (rechts). Für die Berechnung wurden thermophysikalische Daten [17, 18] und die folgende Reaktionsgleichung verwendet: C3S + 3.917 H2O ➞ 1.7Ca(OH)2-SiO2-0.917H2O + 1.3 Ca(OH)2](https://www.zkg-online.info/imgs/tok_27fe079a288eb02a94e328819031db93/w221_h135_x110_y67_101516303_3486673949.jpg)